Contents
Lợi ích của việc thực hiện GMP
– Nếu không theo GMP, có thể gặp nhiều sai sót, sản phẩm bị thu hồi
– GMP giúp mở rộng hơn cơ hội xuất khẩu thuốc
– Thuốc kém chất lượng dẫn tới mất lòng tin của các nhà cung cấp dịch vụ y tế và của khách hàng. Vì vậy thực hiện GMP để đảm bảo chất lượng tốt, đảm bảo uy tín của nhà sản xuất thuốc
Thực trạng của nền công nghiệp dược Việt Nam

Tổng số cơ sở sản xuất thuốc đạt GMP tính đến tháng 7 năm 2008 là trên 70, doanh số khoảng 90%
Khoảng trên 10 doanh nghiệp đang triển khai GMP
Phân chia giữa các miền không đồng đều, tập trung nhiều ở các tỉnh phía nam
Phân loại theo hệ thống của GMP – WHO có 4 cấp:
+ Cấp độ 1: Hoàn toàn nhập khẩu
+ Cấp độ 2: Sản xuất được một số thuốc genaric, đa số phải nhập khẩu
+ Cấp độ 3: Có nền công nghiệp dược nội địa, xuất khẩu được một số dược phẩm
+ Cấp độ 4: Sản xuất được nguyên liệu và phát minh thuốc mới
Công nghiệp dược Việt Nam đang ở mức độ khoảng từ 2,5 đến 3
10 nguyên tắc cơ bản của GMP
1, Viết ra những gì cần làm
2, Làm theo những gì đã viết
3, Ghi kết quả đã làm vào hồ sơ
4, Thẩm định các quy trình
5, Sử dụng hợp lý thiết bị
6, Bảo trì thiết bị theo kế hoạch
7, Đào tạo thường xuyên và cập nhật
8, Giữ gìn sạch sẽ và ngăn nắp
9, Cảnh giác cao và chất lượng
10, Kiểm tra sự thực hiện đúng
Kế hoạch triển khai GMP-WHO ở nước ta
Áp dụng theo quyết định số 3886/2004/QĐ-BYT ban hành ngày 3-11-2004 và Quyết định số 27/2007/QĐ-BYT ban hành ngày 19-4-2007 của Bộ trưởng Bộ Y Tế
– Đối với cơ sở mới bắt đầu sản xuất thuốc tân dược từ ngày 01 tháng 07 năm 2008 đều phải đạt GMP – WHO (bao gồm cả GMP, GSP, GLP)
– Đối với cơ sở đã sản xuất thuốc tân dược đã có GMP – ASEAN phải chuyển đổi sang GMP – WHO (bao gồm cả GMP, GSP, GLP) đến hết ngày 31 tháng 6 năm 2008
– Đối với cơ sở đã đạt GMP – ASEAN thì giấy chứng nhận chỉ có giá trị đến hết ngày 31 tháng 6 năm 2008
– Đến hết ngày 31 tháng 12 năm 2005, sản xuất thuốc tiêm, tiêm truyền, kháng sinh beta lactam phải đạt GMP – ASEAN hoặc GMP – WHO
– Từ ngày 1 tháng 1 năm 2011, sản xuất thuốc từ dược liệu hoặc thuốc dùng ngoài phải đạt tiêu chuẩn GMP – WHO
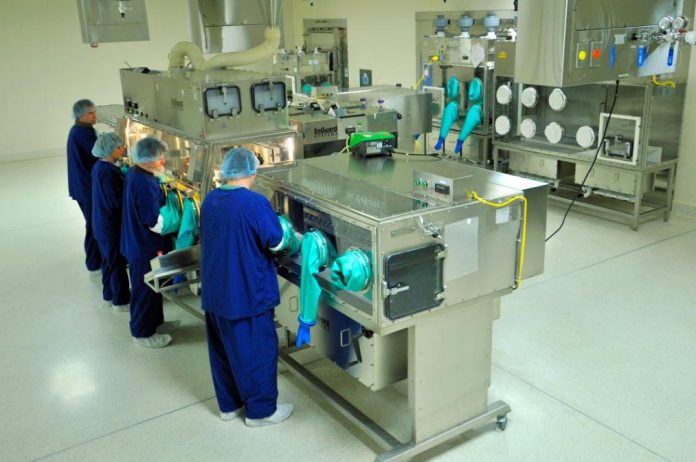
Những nội dung cơ bản ghi trong hướng dẫn thực hành tốt sản xuất thuốc
- Đảm bảo chất lượng thuốc
- sản xuất
- Biện pháp và tiêu chuẩn vệ sinh
- Thẩm định
- Xử lý khiếu nại
- Thu hồi sản phẩm
- Sản xuất và kiểm nghiệm theo hợp đồng
- Tự thanh tra và thanh tra chất lượng
- Nhân viên
- Đào tạo
- Vệ sinh cá nhân
- Nhà xưởng
- Thiết bị
- Nguyên vật liệu
- Hồ sơ, tài liệu
Năm yếu tố quan trọng của GMP
Con người là yếu tố quan trọng nhất, tác động trực tiếp đến việc đảm bảo hiệu quả sản xuất và chất lượng thuốc. Con người trong sản xuất đạt chuẩn GMP phải được huấn luyện đầy đủ, có tinh thần trách nhiệm cao, có lòng nhiệt thành và có kỷ luật
Thiết bị phải đạt tiêu chuẩn theo quy định
Nguyên liệu phải đảm bảo chất lượng, có nguồn gốc xuất xứ rõ ràng
Quy trình được xây dựng dựa trên các quy trình thao tác chuẩn để công nhân, cán bộ chuyên môn dựa vào đó để thực hiện đúng, đảm bảo chất lượng sản phẩm
Môi trường: sản xuất thuốc phải gắn liền với bảo vệ môi trường
copy ghi nguồn : daihocduochanoi.com
Link bài viết tại : Tiến trình thực hiện GMP ở nước ta

![[Review] Cao Dây thìa canh chuẩn hoá Mamigo dành cho người tiểu đường có tốt không? Có nên mua không? Cao Dây thìa canh chuẩn hoá Mamigo dành cho người tiểu đường](https://daihocduochanoi.com/wp-content/uploads/2022/03/cao-day-thia-canh-chuan-hoa-mamigo-218x150.jpg)




![[REVIEW] 5 lý do người bệnh gan nên sử dụng CAO VỊ CAN Thực phẩm chức năng Cao Vị Can](https://daihocduochanoi.com/wp-content/uploads/2022/11/Thuc-pham-chuc-nang-Cao-Vi-Can-218x150.jpg)
![[Review] Siro ăn ngon Fitobimbi Appetito có thật sự tốt không? Fitobimbi Appetito](https://daihocduochanoi.com/wp-content/uploads/2022/11/Fitobimbi-Appetito-2-218x150.jpg)


![[VẠCH TRẦN] Sữa non Babego có tốt không? Sự thật ít ai chia sẻ? Cơ chế tác động của sữa non Babego](https://daihocduochanoi.com/wp-content/uploads/2022/12/6-1-218x150.jpg)